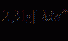Эквивалент. закон зквивалентов. определение эквивалентной массы вещества
Содержание
- 1 ссылки
- 2 Особенности сварки низколегированных сталей
- 3 Техника анализа классов эквивалентности
- 4 Применяемые определения и теоремы
- 5 Пример подсчета закона эквивалента
- 6 Предостережение
- 7 Замена функций эквивалентными при вычислении предела:
- 8 Теорема о замене функций эквивалентными в пределе частного
- 9 приложений
- 10 1.1.2 Эквивалентная масса (молярная масса эквивалента вещества)
- 11 Эквивалент сложного вещества
- 12 Параметры (Fs, Qts, Vas)
- 13 Как рассчитать это? примеров
- 14 Эквивалент элемента
- 15 ВАЖНЕЙШАЯ ОСОБЕННОСТЬ ПРЕДЕЛА, КАК ПОНЯТИЯ
ссылки
- Дей, Р. А. JR. А Андервуд А. Л. Количественная аналитическая химия. Перевод 5в Английское издание. Редакция Прентис Холл Интеримериана
- Неорганическая химия (Н.Д.). Определение эквивалентной массы оксидов. Получено с: fullquimica.com
- Wikipedia. (2018). Эквивалентный вес. Получено с: en.wikipedia.org
- Редакция Британской энциклопедии. (26 сентября 2016 г.) Эквивалентный вес. Энциклопедия Британника. Получено с: britannica.com
- Ори, Джек. (30 апреля 2018 г.) Как рассчитать эквивалентный вес. Sciencing. Получено от: sciencing.com
- Эквивалентный вес кислоты. Часть 2. Титрование образца неизвестной кислоты. (Н.Д.). Получено с: faculty.uml.edu
- Бергстрессер М. (2018). Эквивалентный вес: определение и формула. Исследование. Получено с: study.com
Особенности сварки низколегированных сталей
Сварка конструкционных сталей 15ХСНД, 15ГС, 14Г2, 14Г2АФ, 16Г2АФ
Для сварки низколегированных сталей марок 15ХСНД, 15ГС, 14Г2, 14Г2АФ, 16Г2АФ
и т.п. хорошо подходит ручная дуговая сварка электродами Э50А или Э44А. Но наиболее
качественные сварные соединения получаются при сварке электродами УОНИ-13/55
и ДСК-50. Но, лучшие результаты получаются при сварке постоянным током при обратной
полярности. При этом, сварку необходимо проводить при пониженных токах, 40-50
А на миллиметр диаметра электрода.
Автоматическую дуговую сварку данных марок сталей выполняют сварочной проволокой
Св-08ГА или Св-10ГА под флюсами АН-348-А или ОСЦ-45.
Металлоконструкции из сталей 15ХСНД, 15ГС, 14Г2, 14Г2АФ, 16 Г2АФ можно сваривать
при температуре окружающей среды не ниже -10°C. Если же температура окружающей
среды находится в пределах от -10°C до -25°C, то при сварке необходим предварительный
подогрев. Ширина подогрева зоны сварки составляет 100-120 мм по обе стороны
шва. Температура предварительного подогрева 100-150°C. При температуре окружающей
среды ниже, чем -25°C, сварка вышеуказанных сталей не допустима.
Сварка низколегированных сталей 09Г2С, 10Г2С1, 10Г2С1Д
Оценку
свариваемости сталей таких марок, как 09Г2С, 10Г2С1, 10Г2С1Д и т.п. можно
дать хорошую (см. таблицу
свариваемости сталей), и связано это с тем, что они не подвержены закаливанию,
не склонны к перегреву и устойчивы к образованию горячих и холодных
трещин в сварном шве и зоне
термического влияния. Сварку низколегированных конструкционных сталей данных
марок можно выполнять как ручной дуговой сваркой, так и автоматической.
При ручной сварке хорошо подходят электроды марок Э50А и Э55А. При автоматической
сварке используют сварочную проволоку марок Св-08ГА, Св-10ГА или Св-10Г2. Для
защиты зоны сварки применяют флюсы АН-348-А или ОСЦ-45.
Сварка листов из сталей 09Г2С, 10Г2С1, 10Г2С1Д, толщиной менее 40 мм выполняется
без разделки кромок. И, при соблюдении технологии и режимов сварки, механические
свойства сварочного шва почти не уступают механическим свойствам основного металла.
Равнопрочность сварного шва обусловлена переходом легирующих элементов из электродной
проволоки в металл сварного шва.
Сварка хромокремнемарганцовистых низколегированных сталей 25ХГСА,
30ХГСА, 35ХГСА
Сварка низколегированных сталей 25ХГСА, 30ХГСА, 35ХГСА и т.п. затруднена тем,
что они склонны к образованию трещин при сварке и к появлению закалочных структур.
И чем меньше толщина свариваемых кромок, тем выше риск образования закалочных
зон и появления трещин в металле шва и, особенно, околошовной зоне.
Склонность данных сталей к сварным дефектам обусловлена повышенным содержанием
углерода в их составе (0,25% и более). Сварку этих сталей можно выполнять сварочной
проволокой Св-08 или Св08А, а также электродами данных марок.
Для особоответственных сварных швов рекомендуют применять электроды Св-18ХГСА
или Св-18ХМА с защитным покрытием следующих видов: ЦЛ-18-63, ЦК18М, УОНИ-13/65,
УОНИ-13/85, УОНИ-13/НЖ.
При сварке низколегированных хромокремнемарганцовистых сталей, в зависимости
от толщины свариваемого металла, рекомендуются следующие режимы сварки:
| Толщина металла, мм | 0,5-1 | 2-3 | 4-6 | 7-10 |
| Диаметр электрода, мм | 1,5-2,0 | 2,5-3,0 | 3-5 | 4-6 |
| Сварочный ток, А | 20-40 | 50-90 | 100-160 | 200-240 |
При сварке металлов, толщиной
более 10мм, выполняют многослойную сварку с небольшими промежутками по времени
между выполнеием последующих слоёв. В случае, когда свариваются детали разной
толщины, сварочный ток выбирают по больше толщине и на неё направляется бОльшая
зона дуги.
После сварки рекомендуется провести термообработку для устранении закалочных
структур. Для этого изделие нагревают до температуры 650-680 ?С, выдерживают
эту температуру по времени, в зависимости от толщины металла (1ч на 25мм толщины)
и охлаждают на воздухе, либо в воде.
Сварка низколегированных конструкционных сталей в защитных газах выполняется
по режимам для автоматической или полуавтоматической сварки под флюсом. В случае,
выполнения сварки в среде углекислого газа, применяют сварочную проволоку марки
Св-08Г2С, или Св-10Г2 диаметром 1,2-2мм.
В случае применения электрошлаковой сварки, выбирают сварочную проволоку марки
Св-10Г2, которая подходит для любой толщины свариваемых деталей. В качестве
защиты применяют флюс АН-8. При таком способе
сварки вести сварку можно при любой температуре.
Дополнительные материалы по теме:
|
Сварка |
Сварка мартенситных сталейСварка среднелегированных высокопрочных сталейСварка теплоустойчивых сталей |
Техника анализа классов эквивалентности
это техника, при которой мы разделяем функционал (часто диапазон возможных вводимых значений) на группы эквивалентных по своему влиянию на систему значений. Такое разделение помогает убедиться в правильном функционировании целой системы — одного класса эквивалентности, проверив только один элемент этой группы. Эта техника заключается в разбиении всего набора тестов на классы эквивалентности с последующим сокращением числа тестов.
 Техника анализа классов эквивалентности
Техника анализа классов эквивалентности
Техника рекомендует проведение тестов для всех классов эквивалентности, хотя бы по одному тесту для каждого класса. Техника анализа классов эквивалентности стремитсяне только сокращать количество тестов, но и сохранять приемлемое тестовое покрытие.
Признаки эквивалентности тестов
- направлены на поиск одной и той же ошибки;
- если один из тестов обнаруживает ошибку, другие скорее всего, тоже её обнаружат;
- если один из тестов не обнаруживает ошибку, другие, скорее всего, тоже её не обнаружат;
- тесты используют схожие наборы входных данных;
- для выполнения тестов мы совершаем одни и те же операции;
- тесты генерируют одинаковые выходные данные или приводят приложение в одно и то же состояние;
- все тесты приводят к срабатыванию одного и того же блока обработки ошибок;
- ни один из тестов не приводит к срабатыванию блока обработки ошибок.
Техника анализа классов эквивалентности алгоритм использования:
Определить классы эквивалентности.
Это главный шаг техники, т.к. во многом от него зависит эффективность её применения.
- Выбрать одного представителя от каждого класса эквивалентности.
На этом этапе следует выбрать один тест из эквивалентного набора тестов.
- Выполнение тестов.
На этом шаге следует выполнить тесты от каждого класса эквивалентности.
Если есть время, можно протестировать еще несколько представителей от каждого класса эквивалентности. Следует иметь ввиду, при правильном определение классов эквивалентности дополнительные тесты скорее всего будут избыточными и дадут такой же результат.
На практике классы эквивалентности обязательны при тестировании всевозможных форм и полей ввода.
Плюсы и минусы техники анализа эквивалентных классов
К плюсам можно отнести отсеивание огромного количества значений ввода, использование которых просто бессмысленно.
К минусам можно отнести неправильное использование техники, из-за которого есть риск упустить баги.
Подытожим — Техника анализа классов эквивалентности одна из нескольких часто применяемых техник при планировании и разработке тестов. Значительно сокращает количество тестов необходимых для проверки функционала и время, с другой стороны в не опытных руках может стать инструментом который не только не поможет найти дефекты, но и сложит ошибочное представление о покрытие приложения тестами.
О других техниках читайте здесь:
- Техника анализа граничных значений
- Таблица принятия решений
Применяемые определения и теоремы
Определение эквивалентных функций Функции и называются эквивалентными (асимптотически равными) при при , если на некоторой проколотой окрестности точки , при , причем.
Если при , то ; если , то . При этом функцию называют главной частью при . См.
Теорема о замене функций эквивалентными в пределе частного Если, при , и и существует предел, то существует и предел.
Отметим часто применяемое следствие этой теоремы. Пусть мы имеем частное, составленное из конечного произведения функций: . Тогда, при вычислении предела, эти функции можно заменить на эквивалентные:, где . Знак равенства означает, что если существует один из этих пределов, то существует и равный ему второй. Если не существует один из пределов, то не существует и второй. Разумеется, можно менять не все функции а только одну или некоторые из них.
Пример подсчета закона эквивалента
При соединении 3,5 г железа с серой образовалось 5,5 г сернистого железа. Вычислить эквивалент железа, если эквивалент серы равен 16.
Из данных задачи видно, что в сернистом железе на 3,5 весовых частей железа приходится 5,5 — 3,5 = 2 весовых части серы. А так как эквивалентом железа является такое весовое его количество, которое соединяется с одним эквивалентом серы, то

Так как многие элементы образуют по нескольку соединений друг с другом, то очевидно, что эквивалент элемента может иметь различные значения, смотря по тому, из состава какого соединения он был вычислен. Но во всех таких случаях различные эквиваленты одного и того же элемента относятся друг к другу как небольшие целые числа.
Например, эквиваленты углерода, вычисленные из состава его соединений с кислородом, равны 3 и 6, а отношение между ними 1 : 2.
Понятие об эквивалентах распространяется также и на сложные вещества.
Предостережение
Как указывалось в самом начале, производить замену функций эквивалентными можно только в множителях дробей и произведений, предел которых мы хотим найти. В других выражениях, например в суммах, делать такую замену нельзя.
В качестве примера рассмотрим следующий предел:. При . Но если заменить в числителе на , то получим ошибку:. Ошибки не будет, если выразить синус через эквивалентную функцию и о малое, . Поскольку и , то мы снова получили неопределенность . Это указывает на то, что для вычисления этого предела применение эквивалентной функции не достаточно. Нужно применить другой метод.
Можно решить этот пример разложением в ряд Маклорена:.
Также можно применить правило Лопиталя:.
Замена функций эквивалентными при вычислении предела:
Теорема:
Еслиf\sim f_{1} , а g\sim g_{1} , при x\rightarrow x_{0} , то если \exists\; lim_{x\rightarrow x_{0}}\frac{f_{1}(x)}{g_{1}(x)} , то \exists\; lim_{x\rightarrow x_{0}}\frac{f(x)}{g(x)} и lim_{x\rightarrow x_{0}}\frac{f_{1}(x)}{g_{1}(x)}=lim_{x\rightarrow x_{0}}\frac{f(x)}{g(x)}Замечание:
Если в числителе или знаменателе стоит сумма, то при раскрытии неопределенности заменять отдельные слагаемые эквивалентными величинами нельзя, т.к. такая замена может привести к неверному результату.
Примеры:
1) lim_{x\rightarrow 0}\frac{arcsinx(e^{x}-1)}{cosx-cos3x}=\begin{bmatrix} arcsinx\sim x\\e^{x-1}\sim x \\cosx-cos3x=2sinxsin2x \ \end{bmatrix}\Rightarrow lim_{x\rightarrow 0}\frac{x*x}{4x^{2}}=\frac{1}{4}
2) lim_{x\rightarrow \infty }x(e^{\frac{1}{x}}-1)=\begin{bmatrix} \frac{1}{x}=t\\ x\rightarrow \infty \Rightarrow t\rightarrow 0 \end{bmatrix}=lim_{t\rightarrow 0 }\frac{1}{t}(e^{t}-1)=lim_{t\rightarrow 0}\frac{1}{t}t=lim_{t\rightarrow 0}1=1
- Лысенко З.М. Конспект лекций по курсу математического анализа. (Тема «Сравнение функций»).
- Фихтенгольц Г. М. «Основы математического анализа, том 1» Издание шестое, стереотипное 1968 Изд-во Наука (с. 112-114)
Лимит времени:
из 6 заданий окончено
Вопросы:
- 1
- 2
- 3
- 4
- 5
- 6
Информация
Тест по теме «Эквивалентные функции»
Вы уже проходили тест ранее. Вы не можете запустить его снова.
Тест загружается…
Вы должны войти или зарегистрироваться для того, чтобы начать тест.
Вы должны закончить следующие тесты, чтобы начать этот:
Результаты
Правильных ответов: из 6
Ваше время:
Время вышло
Вы набрали из баллов ()
| Место | Имя | Записано | Баллы | Результат |
|---|---|---|---|---|
| Таблица загружается | ||||
| Нет данных | ||||
Ваш результат был записан в таблицу лидеров
Капча:
- 1
- 2
- 3
- 4
- 5
- 6
-
С ответом
-
С отметкой о просмотре
-
Задание 1 из 6
1.
Дополните утверждение
Понятие эквивалентные обычно используют, когда две функции (бесконечно большие, бесконечно малые) или (бесконечно большие, бесконечно малые)
Правильно
Неправильно
-
Задание 2 из 6
2.
Какими свойствами обладает отношение эквивалентности:
-
Рефлексивность
-
Симметричность
-
Асимметричность
-
Транзитивность
-
Нетранзитивность
Правильно
Неправильно
3 правильных ответа
-
-
Задание 3 из 6
Элементы сортировки
-
$$x$$
-
$$1$$
-
f~g=>g~f
-
f~g, g~h =>f~h
-
$$arctg x~$$
-
$$lim_{x\rightarrow 0}\frac{arcsinx}{x}=$$
-
свойство симметричности
-
свойство транзитивности
Правильно
Неправильно
-
-
Задание 4 из 6
Найдите предел:
$$lim_{x\rightarrow 0}\frac{ln(1+4x)}{sin3x}$$
Правильно
Неправильно
$$ln(1+\alpha )\sim \alpha ; sin\alpha \sim \alpha$$
-
Задание 5 из 6
Элементы сортировки
-
$$x$$
-
$$xlna$$
-
$$\frac{x^{2}}{2}$$
-
$$\alpha x$$
-
$$sh x\sim$$
-
$$a^{x-1\sim }$$
-
$$1-cosx\sim$$
-
$$(1+x)^{\alpha }-1\sim$$
Правильно
Неправильно
-
-
Задание 6 из 6
6.
Для того, чтобы две бесконечно малые были эквивалентны, необходимо и достаточно, чтобы было
-
$$lim\frac{\beta }{\alpha }=1$$
-
$$lim\frac{\beta }{\alpha }=0$$
-
$$lim\frac{\beta }{\alpha }=\infty$$
Правильно
Неправильно
-
Теорема о замене функций эквивалентными в пределе частного
Если при x1, стремящимся к x2, f(x)~f1(x) и g(x)~g1(x) существует предел:
то существует и предел:
Доказательство
Допустим, что следствие этой теоремы часто применяемое. Если мы имеем частное, являющееся результатом произведения функций:
в этом случае, при нахождении предела, можно сделать замену этих функций на эквивалентные:
при этом:
f(x) ~ f1(x), p(x) ~ p1(x), … , r(x) ~ r1(x), g(x) ~ g1(x), q(x) ~ q1(x), … , s(x) ~ s1(x).
Выражения равны друг другу, это значит, что при существовании одного из таких пределов, применимо существование выражения, равного первому. Соответственно, если не существует такой предел, то не может существовать и второй.
Следует отметить, что можно делать замену как одной величины функции, так и нескольких одновременно.
приложений
Использование в общей химии
металлы
Использование ПЭ в элементах и химических соединениях было заменено использованием его молярной массы. Основной причиной является наличие элементов и соединений с более чем эквивалентным весом.
Например, железо (Fe), элемент с атомным весом 55,85 г / моль, имеет две валентности: +2 и +3. Следовательно, он имеет два эквивалентных веса: когда он работает с валентностью +2, его эквивалентный вес составляет 27,93 г / экв; в то время как при использовании валентности +3 ее эквивалентный вес составляет 18,67 г / экв..
Конечно, мы не можем говорить о существовании эквивалентного веса Веры, но мы можем указать на существование атомного веса Веры..
кислоты
Фосфорная кислота имеет молекулярную массу 98 г / моль. Эта кислота при диссоциации в H+ + H2ПО4-, Его эквивалентная масса составляет 98 г / экв., Поскольку он выделяет 1 моль H.+. Если фосфорная кислота диссоциирует в H+ + HPO42-, его эквивалентный вес составляет (98 г.моль-1) / (2 экв / моль-1) = 49 г / экв. В этой диссоциации Н3ПО4 выпускает 2 моля H+.
Хотя он не титруем в водной среде, Н3ПО4 может диссоциировать в 3 H+ + ПО43-. В этом случае эквивалентный вес равен (98 г.моль-1) / (3 экв.моль-1) = 32,7 г / экв. H3ПО4 Доставка в этом случае 3 моля H+.
Тогда фосфорная кислота имеет до 3 эквивалентных весов. Но это не единичный случай, например, серная кислота имеет два эквивалентных веса, и углекислота также представлена.
Использовать в объемном анализе
-Чтобы уменьшить ошибки, которые могут быть допущены во время взвешивания веществ, использование вещества с более высокой эквивалентной массой является предпочтительным в аналитической химии. Например, при оценке растворов гидроксида натрия с кислотами разной эквивалентной массы. Рекомендуется использовать кислоту с большей эквивалентной массой.
-При использовании массы твердой кислоты, которая может реагировать с гидроксидом натрия, у вас есть возможность выбора между тремя твердыми кислотами: дигидрат щавелевой кислоты, фталевая кислота калия и гидройодат калия, с эквивалентными весами соответственно 63,04 г / экв, 204,22 г / экв и 389 г / экв.
В этом случае предпочтительно использовать перекись водорода калия при оценке гидроокиси натрия, так как относительная погрешность, которая допускается при ее взвешивании, ниже при наличии большей эквивалентной массы..
Использование в гравиметрическом анализе
Эквивалентный вес определяется по-своему в этой методике для анализа веществ. Здесь масса осадка соответствует одному грамму аналита. Это элемент или соединение, представляющее интерес в проводимом исследовании или анализе.
В гравиметрии часто называют результаты анализов в виде доли массы аналита, часто выражаемой в процентах..
Коэффициент эквивалентности объясняется как численный коэффициент, на который умножается масса осадка для получения массы аналита, обычно выражаемой в граммах..
Гравиметрическое определение никеля
Например, при гравиметрическом определении никеля содержащий его осадок представляет собой бис (диметилглиоксилат) никеля с молярной массой 288,915 г / моль. Молярная масса никеля составляет 58,6934 г / моль.
Молярная масса осадка между молярной массой никеля дает следующий результат:
288,915 гмоль-1/ 58,6934 г.моль-1 = 4,9224. Это означает, что 4,9224 г соединения равно 1 г никеля; или, другими словами, 4,9224 г осадка содержат 1 г никеля.
Коэффициент эквивалентности рассчитывается путем деления молярной массы никеля на молярную массу осадка, который его содержит: 58,693 г.моль-1/ 288,915 гмоль-1 = 0,203151. Это говорит нам о том, что на грамм никельсодержащего осадка приходится 0,203151 г никеля..
Используется в химии полимеров
В химии полимеров эквивалентный вес реагента для полимеризации представляет собой массу полимера, который имеет эквивалент реакционной способности.
Это особенно важно в случае ионообменных полимеров: один эквивалент ионообменного полимера может обменивать один моль заряженных ионов; но только половина моль двухзарядных ионов. Обычно реакционную способность полимера выражают в виде обратной величины эквивалентной массы, которая выражается в единицах ммоль / г или мэкв / г.
Обычно реакционную способность полимера выражают в виде обратной величины эквивалентной массы, которая выражается в единицах ммоль / г или мэкв / г..
1.1.2 Эквивалентная масса (молярная масса эквивалента вещества)
Эквивалентная масса (молярная масса эквивалента вещества) mэкв также является одной из важнейших характеристик вещества. По определению эквивалент вещества — это такое количество химического вещества, которая реагирует с 1 г водорода или вытесняет такое же количество водорода из его соединений. Величина mэкв определяется или экспериментально, или, чаще всего, исходя из химической формулы вещества и его принадлежности к тому или иному классу химических соединений (мы будем рассматривать только неорганические соединения)
mэкв(оксида) = Моксида/(число атомов кислорода·2);
mэкв(основания) = Моснования/кислотность основания;
mэкв(кислоты) = Мкислоты/основность кислоты;
mэкв(соли) = Мсоли/(число атомов металла·валентность металла).
Можно отметить, что в большинстве случаев кислотность основания равна числу гидроксильных групп в формуле основания, а основность кислоты равна числу атомов водорода в формуле кислоты.
Например: mэкв(Fe2O3) = М(Fe2O3)/(3·2) = 160/6 = 26,7 г/моль;
mэкв(H2SO4) = M(H2SO4)/2 = 98/2 = 49 г/моль;
mэкв(Ca(OH)2) = M(Ca(OH)2)/2 = 74/2 = 37 г/моль;
mэкв(Al2(SO4)3) = M(Al2(SO4)3) = 342/2 = 171 г/моль;
Эквивалентные массы веществ используют для количественных расчетов при химических взаимодействиях между веществами. Огромным преимуществом при этом является то, что для этого не нужно использовать уравнение химической реакции (которое во многих случаях написать затруднительно), нужно только знать, что данные химические вещества взаимодействуют между собой или вещество является продуктом химической реакции.
Для количественных расчетов используется закон эквивалентов: массы реагирующих и образующихся веществ относятся друг к другу, как их эквивалентные массы.
Математическое выражение закона эквивалентов имеет следующий вид:
| m1/m2 = mэкв(1)/mэкв(2) | (1.2) |
где: m 1 и m 2 — массы реагирующих или образующихся веществ,
mэкв(1) и mэкв(2) — эквивалентные массы этих веществ.
Пример: определить массу соды (карбоната натрия) Na2CO3, необходимую для полной нейтрализации 1,96 кг серной кислоты H2SO4.
Решение:
Воспользуемся законом эквивалентов
m(Na2CO3)/m(H2SO4) = mэкв(Na2CO3)/mэкв( H2SO4)
Определяем эквивалентные массы веществ, исходя из их химических формул:
m (Na2CO3) = 106 /(2·1) = 53 г/моль;
mэкв(H2SO4) = 98/2·1 = 49 г/моль.
Тогда:
Х / 1,96кг = 53 г/моль / 49 г/моль
Х = 2,12 кг.
Эквивалент сложного вещества
Эквивалентом сложного вещества называется такое весовое количество его, которое взаимодействует без остатка с одним эквивалентом водорода (1,008 вес. ч.) или кислорода (8 вес. ч.) или вообще с одним эквивалентом любого другого вещества.
Пример, при пропускании водорода над накаленной окисью меди 1 г водорода восстанавливает 40 г окиси меди. Последнее число и является эквивалентом окиси меди. Эквивалент серной кислоты равняется 49, так как 49 вес. ч. серной кислоты взаимодействуют без остатка с одним эквивалентом магния, цинка и других металлов. В свою очередь, окись меди и серная кислота будут взаимодействовать друг с другом без остатка, если на 40 вес. ч. окиси меди взять 49 вес. ч. серной кислоты.
Статья на тему Закон эквивалентов
Параметры (Fs, Qts, Vas)
Fs — резонансная частота динамика
Резонансная частота (Fs) — частота резонанса сабвуфера без акустического оформления (без корпуса).
Fs меньше 25 Гц считается низкой, а больше 40 Гц — высокой. Резонансная частота зависит от общей жесткости подвеса сабвуфера и массы его подвижной системы. Общая жесткость, в свою очередь, зависит от жесткости центрирующей шайбы и жесткости подвеса диффузора.
Qts — полная добротность
Полная добротность (Qts) — это упругость (контроль) динамика в районе резонансной частоты (Fs).
Другими словами — чем выше добротность, тем сильнее «болтается» саб в районе своей резонансной частоты (Fs), а чем ниже, тем эффективнее колебания гасятся (контролируются).
Складывается из механической добротности, которая зависит в основном от материала центрирующей шайбы, а не подвеса диффузора, как многие думают и электрической добротности, зависящей от величины магнита, длины обмотки катушки и ширины зазора в магнитной системе. От полной добротности механическая составляет 10-15%, а электрическая 90-85%, соответственно.
Низкой добротностью считается значение 0.3-0.35, высокой — 0.5-0.6.
Vas — эквивалентный объем
Эквивалентный объем (Vas) — объем воздуха в корпусе, обладающий той же упругостью, что и сабвуфер. Зависит от жесткости подвеса и площади диффузора (диаметра) динамика.
Чем больше диаметр и мягче сабвуфер, тем больше Vas.
Нужно отметить особенность связи Vas и Fs. Так как, резонансная частота (Fs) определяется жесткостью подвеса и массой подвижной системы, а эквивалентный объем (Vas) — диаметром диффузора и той же массой подвижки, может получится, что два сабвуфера одного диаметра и с одинаковой Fs будут совершенно разными — один тяжелый и жесткий, другой легкий и мягкий. Соответственно, эквивалентный объем для этих динамиков будет совершенно разным, как и размер правильного корпуса — вот почему данный параметр очень важен при расчетах короба для саба.
Видео
Используйте параметры Тиля — Смолла для того, чтобы рассчитать корпус для сабвуфера. Применяйте эти параметры для правильного выбора типа корпуса сабвуфера (ЗЯ, ФИ, ЧВ, FreeAir) или для подбора динамика под задуманный тип, как это правильно сделать читайте здесь.

Читать еще:
- (АЧХ) Амплитудно-частотная характеристика
- Как рассчитать корпус для сабвуфера
- Из чего состоит сабвуфер
Жмите на кнопку чтобы поделиться материалом:
Как рассчитать это? примеров
-Эквивалентный вес химического элемента
Он получается путем деления его атомного веса на его валентность:
Peq = Pa / v
Есть элементы, которые имеют только эквивалентный вес, и элементы, которые могут иметь 2 или более.
Атомный вес = 40 г / моль
Валенсия = +2
Peq = 40 г.моль-1/2eq.mol-1
20 г / экв
Атомный вес = 27 г / моль
Валенсия = +3
Peq = 27 г.моль-1/ 3 экв.моль-1
9 г / экв
Никель эквивалентный вес
Атомный вес = 58,71 г / моль
Валенсия = +2 и +3
Никель имеет два эквивалентных веса, соответствующих тому, когда он реагирует с валентностью +2 и когда он реагирует с валентностью +3.
Peq = 58,71 г моль-1/ 2 экв.моль-1
29,35 г / экв
Peq = 58,71 г моль-1/ 3 экв.моль-1
19,57 г / экв
-Эквивалентная масса оксида
Один из способов расчета эквивалентной массы оксида состоит в делении его молекулярной массы на произведение валентности металла на индекс металла.
Peq = Pm / V · S
Pm = молекулярная масса оксида.
V = снос металла
S = металлический индекс
Продукт V · S называется общим или чистым зарядом катиона..
Эквивалентная масса оксида алюминия (Al2О3)
Молекулярный вес = Al (2 х 27 г / моль) + O (3 х 16 г / моль)
102 г / моль
Валенсия = +3
Субиндекс = 2
Peq Al2О3 = Пм / В · С
Peq Al2О3 = 102 г.моль-1/ 3 эквмоль-1. 2
17 г / экв
Существует еще один способ решения этой проблемы, основанный на стехиометрии. В 102 г оксида алюминия содержится 54 г алюминия и 48 г кислорода..
Peq del Al = Атомный вес / Валенсия
27 г.моль-1/ 3 экв.моль-1
9 г / экв
На основании эквивалентного веса алюминия (9 г / экв.) Рассчитано, что в 54 г алюминия содержится 6 эквивалентов алюминия..
Тогда из свойств эквивалентов: 6 эквивалентов алюминия будут реагировать с 6 эквивалентами кислорода с образованием 6 эквивалентов оксида алюминия..
В 102 г. оксида алюминия есть 6 эквивалентов.
Поэтому:
Peq of Al2О3 = 102 г / 6 экв
17 г / экв
-Эквивалентный вес базы
Эквивалентный вес получают путем деления его молекулярного веса на количество оксигидрильных групп (ОН).
Эквивалентная масса гидроксида железа, Fe (ОН)2
Молекулярный вес = 90 г / моль
ОН число = 2
Peq Fe (OH)2 = 90 г.моль-1/ 2 экв.моль-1
45 г / экв
-Эквивалентный вес кислоты
Как правило, его получают путем деления его молекулярной массы на количество водорода, который выделяется или выделяется. Однако полипротонные кислоты могут диссоциировать или высвобождать Н в различных формах, поэтому они могут иметь более чем эквивалентную массу..
Эквивалентная масса HCl = молекулярная масса / водородное число
Peq HCl = г.моль-1/ 1 экв.моль-1
36,5 г / экв
Эквивалентная масса серной кислоты
Серная кислота (ч2SW4) может быть разделена двумя способами:
H2SW4 => H+ + HSO4—
H2SW4 => 2 H+ + SW42-
Когда вы выпускаете H+ Ваш PE это:
Молекулярный вес = 98 г / моль
Peq = 98 г.моль-1/ 1 экв.моль-1
98 г / пек
И когда он выпускает 2H+:
Молекулярный вес = 98 г / моль
Peq = 98 г.моль-1/ 2 экв.моль-1
49 г / экв
По той же причине фосфорная кислота (H3ПО4) с молекулярной массой 98 г / моль, может иметь до трех эквивалентных масс: 98 г / экв, 49 г / экв и 32,67 г / экв.
-Эквивалентный вес соли
И, наконец, вы можете рассчитать эквивалентную массу соли, разделив ее молекулярную массу на произведение валентности металла на индекс металла.
PE = PM / V · S
Fe железный сульфат2(SO4)3
Молекулярный вес = 400 г / моль
Валенсия железа = +3 экв / моль
Железный индекс = 2
Peq = 400 г.моль-1/ 3 экв.моль-1 х 2
66,67 г / экв
Эквивалент элемента
В настоящее время эквивалентом элемента называется весовое количество его, соединяющееся с восьмью весовыми частями кислорода или с 1,008 весовыми частями водорода или замещающее их в соединениях.
Введение понятия эквивалент позволило сформулировать следующий закон, называемый законом эквивалентов:
Элементы соединяются друг с другом в весовых количествах, пропорциональных их эквивалентам.
Эквиваленты обычно находят или по данным анализа различных соединений, или на основании результатов замещения одного элемента другим. Следует подчеркнуть, что для определения эквивалентов совершенно необязательно исходить из соединений с кислородом или водородом. Пользуясь законом эквивалентов, можно вычислить эквивалент по составу соединения данного элемента с любым другим, эквивалент которого известен.
ВАЖНЕЙШАЯ ОСОБЕННОСТЬ ПРЕДЕЛА, КАК ПОНЯТИЯ
состоит в том, что «икс» бесконечно близко приближается к некоторой точке , но «заходить туда» он «не обязан»! То есть для существования предела функции в точке не имеет значения, определена ли там сама функция или нет. Более подробно об этом можно прочитать в статье Пределы по Коши, ну а пока что вернёмся к теме сегодняшнего урока:
Во-вторых, функции числителя и знаменателя должны быть бесконечно малЫ в данной точке. Так, например, предел совсем из другой команды, здесь функция числителя не стремится к нулю: .
Систематизируем информацию о сравнении бесконечно малых функций:
Пусть – бесконечно малые функции в точке (т.е. при ) и существует предел их отношений . Тогда:
1) Если , то функция более высокого порядка малости, чем .
Простейший пример: , то есть кубическая функция более высокого порядка малости, чем квадратичная.
2) Если , то функция более высокого порядка малости, чем .
Простейший пример: , то есть квадратичная функция более высокого порядка малости, чем линейная.
3) Если , где – ненулевая константа, то функции имеют одинаковый порядок малости.
Простейший пример: , иными словами, карлик бежит к нулю строго в два раза медленнее, чем , и «дистанция» между ними сохраняется постоянной.
Наиболее интересен частный случай, когда . Такие функции называют бесконечно малыми эквивалентными функциями.
Перед тем как привести элементарный пример, поговорим о самом термине. Эквивалентность. Данное слово уже встречалось на уроке Методы решения пределов, в других статьях и встретится ещё неоднократно. Что такое эквивалентность? Существует математическое определение эквивалентности, логическое, физическое и т.д., но попытаемся понять саму сущность.
Эквивалентность – это равнозначность (или равноценность) в каком-нибудь отношении. Самое время размять мышцы и немного отдохнуть от высшей математики
Сейчас на улице хороший январский морозец, поэтому очень важно хорошо утеплиться. Пожалуйста, пройдите в прихожую и откройте шкаф с одеждой
Представьте, что там висят два одинаковых тулупа, которые отличаются только цветом. Один оранжевый, другой фиолетовый. С точки зрения своих согревающих качеств, данные тулупы являются эквивалентными. И в первом, и во втором тулупе вам будет одинаково тепло, то есть выбор равноценен, что оранжевый надеть, что фиолетовый – без выигрыша: «один к одному равно одному». Но вот с точки зрения безопасности на дороге тулупы уже не эквивалентны – оранжевый цвет лучше заметен водителям транспорта, …да и патруль не остановит, потому что с обладателем такой одежды и так всё понятно. В этом отношении можно считать, что тулупы «одного порядка малости», условно говоря, «оранжевый тулуп» в два раза «безопаснее» «фиолетового тулупа» («который хуже, но тоже заметен в темноте»). А если выйти на мороз в одном пиджаке и носках, то разница будет уже колоссальной, таким образом, пиджак и тулуп – «разного порядка малости».
…зашибись, нужно запостить в Википедии со ссылкой на данный урок =) =) =)
Напрашивающийся пример бесконечно малых эквивалентных функций вам хорошо знаком – это функции первого замечательного предела .
Дадим геометрическое истолкование 1-го замечательного предела. Выполним чертёж:
Ну вот, крепкая мужская дружба графиков виднА даже невооруженным взглядом. А бесконечно близко вблизи нуля их и мама родная не отличит. Таким образом, если , то функции бесконечно малЫ и эквивалентны. А если разница ничтожно мала? Тогда в пределе синус вверху можно заменить «иксом»: , или «икс» внизу синусом: . По сути, получилось геометрическое доказательство первого замечательного предела =)
Аналогично, кстати, можно проиллюстрировать любой замечательный предел, который равен единице.
! Внимание! Эквивалентность объектов не подразумевает совпадение объектов! Оранжевый и фиолетовый тулупы эквивалентно теплЫ, но это разные тулупы. Функции практически неотличИмы вблизи нуля, но это две разные функции
Обозначение: эквивалентность обозначается значком «тильда».
Например: – «синус икса эквивалентен иксу», если .
Из вышесказанного следует очень важный вывод: если две бесконечно малые функции эквивалентны, то одну можно заменить другой. Данный приём широко применяется на практике, и прямо сейчас мы увидим, каким образом: